PROTACの対となるか?〜脱ユビキチン化を促進するキメラ化合物〜
AmgenのKRAS-G12C阻害剤 Sotorasib(AMG510)が承認されましたね!*1 ケミカルバイオロジーの発展に端を発する化合物で、難攻不落と言われていたKRASを標的とする医薬品が誕生したのはとても素晴らしいです。*2
低分子医薬品の世界も、標的となるタンパクが広がったり、PROTACにMolecular glueといった新しいアプローチが実用化に向けてどんどん開発されていて眺めていて楽しいです。
で、コンセプトが明確で、なるほど面白い!そうなるかー!と思ったアプローチを知りました。「Targeted protein stabilization (TPS)」というもので、雑にまとめると「PROTACの逆をいくキメラ化合物」です。
bioRxivに論文が公開されていたのでご紹介。*3
Targeted protein stabilization
さて、こちらの論文で提案されているアプローチはとても分かりやすいです。
「ユビキチン-プロテアソーム系で分解されるタンパク質に対して、脱ユビキチン化酵素を働かせることで、 分解を抑制して安定化し、機能できる状態を維持しよう」ってな感じです。
変異などにより上手くフォールディングできないタンパク質はユビキチン化を受けプロテアソームで分解されます。 PROTACやMolecular glueはこのシステムを利用して、壊したいタンパク質のユビキチン化を誘導、分解促進するメカニズムでした。
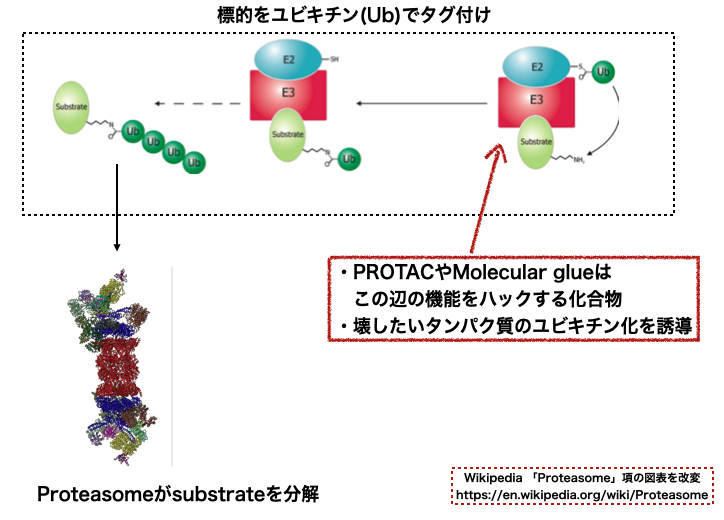
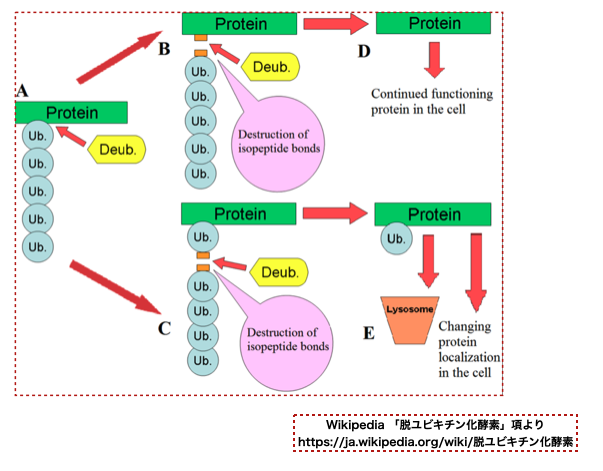
で、上の図には出てきませんが、 ユビキチン-プロテアソーム系を調節する酵素として脱ユビキチン化酵素(deubiquitinating enzyme、DUB)があります。 その名の通り「タンパク質からユビキチンを切断除去するプロテアーゼ」です。*4
Wikipediaの模式図を貼っておきます。上図の逆向きの反応です。
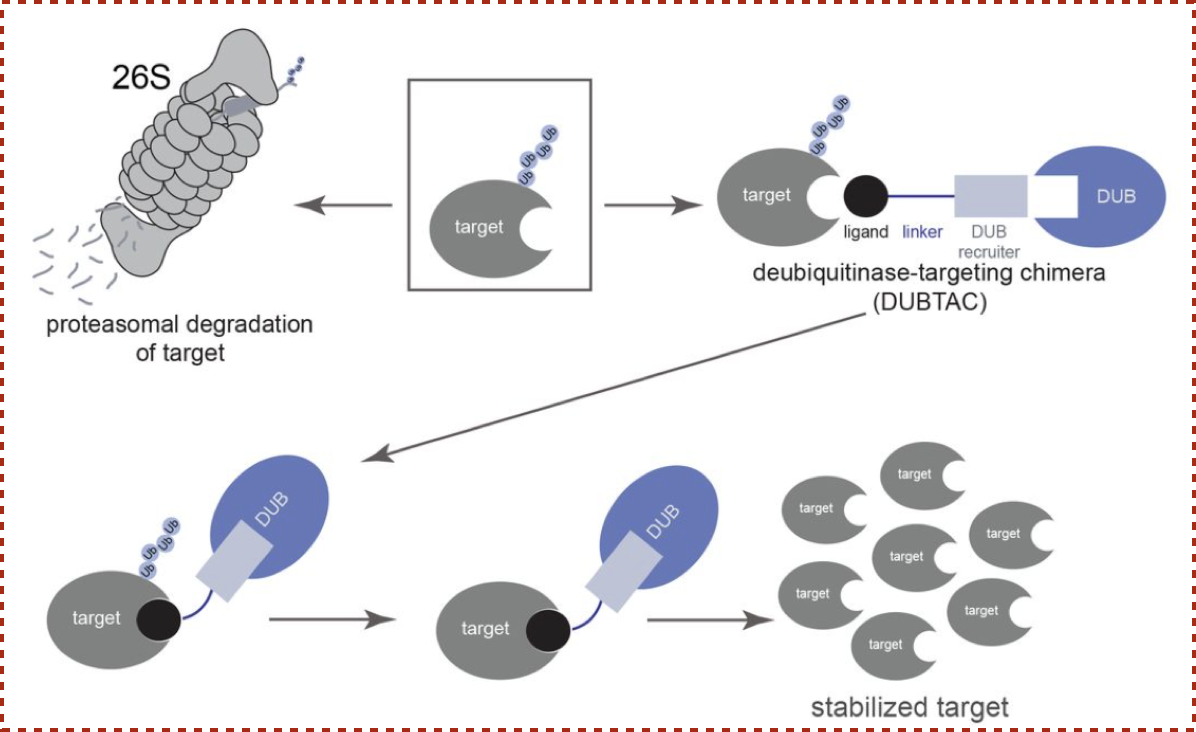
さて、著者らのアプローチはこうです。 「PROTACがユビキチンリガーゼを標的タンパクに近接させることで分解を促進するのなら、 脱ユビキチン化酵素を近接させれば分解を抑制・安定化できるだろう。そのような近接化に働くキメラ化合物を Deubiquitinase-Targeting Chimera(DUBTAC)と呼ぼう。」
比較するとこんな感じの話?
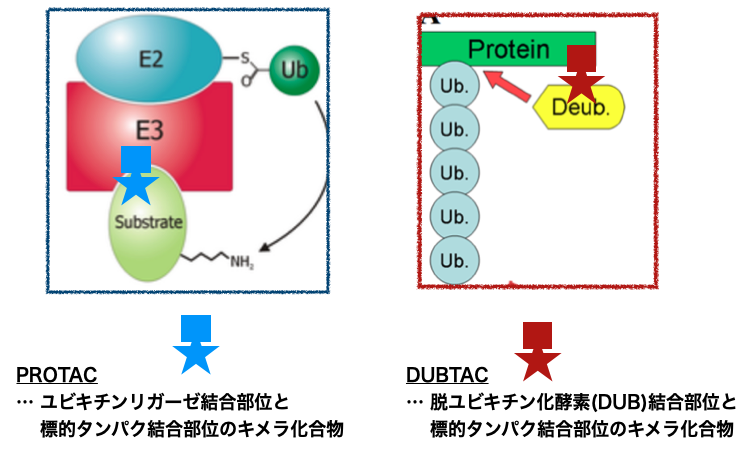
なるほど!!でもどうやってそんな化合物作れば良いんですかね???
DUBTACのデザイン戦略
DUBTACによるTPSを達成するためには大きく4つの課題があります。
- DUBファミリーのうち、どの脱ユビキチン化酵素を利用するか?
- また、その酵素に結合するユニットをどう見つけるか?
- 安定化する標的タンパク質として何を選ぶか?
- また、その標的タンパク質と結合するユニットをどう見つけるか?
著者らは、前2つの課題に対してはケモプロテオミクスを利用することで、 後2つ課題については嚢胞性繊維症(Csytic Fibrosis, CF)の原因CFTRを標的とすることでコンセプト検証(Proof Of Concept)を行っています。
Nomura Research Groupについて
さて、ここで著者情報です。今回のbioRxiv論文は University of California, BerkeleyのDaniel K. Nomura教授らのグループによる報告です(Nomura Research group HP)。 所属としてNovartis-Berkeley Center for Proteomics and Chemistry Technologiesとも記載されています。
こちらはNovartisとUC Berkeleyとが協力し、 「"undruggable"な標的に対する低分子化合物を開発するための次世代の技術」を開発するための組織とのことです*5。新しいモダリティとして深く製薬企業が関わった産学連携の成果なのかもしれません。*6
Nomura研究室の得意とするところは「ケモプロテオミクスを利用した共有結合性リガンドの発見」のようです。
より具体的には「活性ベースタンパク質プロファイリング(Activity-Based Protein Profiling, ABPP)」を利用することで、 「"undruggable"な標的タンパク質に、リガンドが結合可能なユニークなホットスポットがあるか?」、 「ポケットの探索およびそのリガンド(functional covalent ligand)の取得」ができるそうです。*7
今年3月、Acc.Chem.Resに以下のようなレビューも出版されています。
Reimagining Druggability Using Chemoproteomic Platforms Jessica N. Spradlin, Erika Zhang, and Daniel K. Nomura Acc. Chem. Res. 2021, 54, 7, 1801–1813 https://pubs.acs.org/doi/10.1021/acs.accounts.1c00065
では、具体的にどのようにDUBファミリーの探索を行ったのか?、見てみましょう。
DUBファミリーからのOTUB1の選別
さて、DUBファミリーのうち今回の目的に適した脱ユビキチン化酵素の候補をどのように選別すれば良いでしょうか?
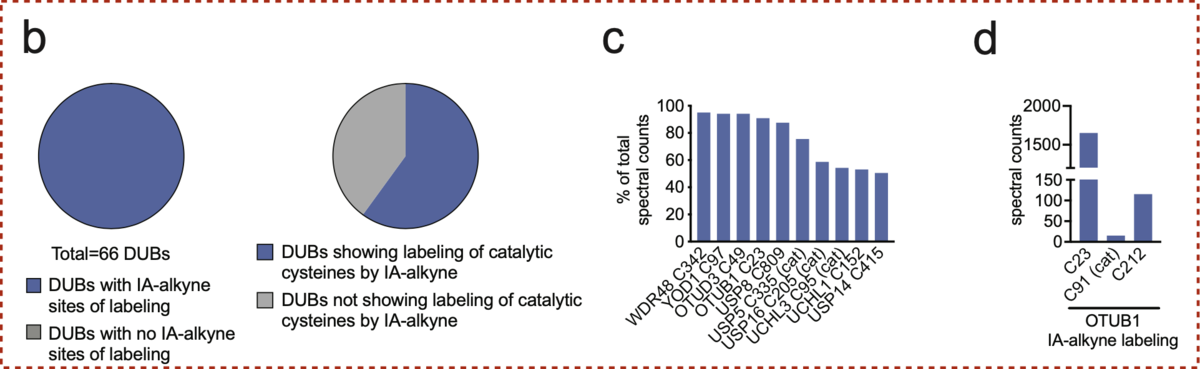
著者らは66種の酵素について、ABPPによるケモプロテオミクスのデータを集めて解析を行いました。 このデータは「酵素のシステイン残基(Cys)について、プローブと反応する残基の位置をラベリングする」というプロファイリングを行ったものです。
目的に合う酵素は以下のような条件を満たすCys残基をもつものです。
- アロステリックな位置 … 触媒ドメインのCysでは、TPSで利用したい酵素本来の活性が失われてしまう
- 同一酵素内での選択性 … 同じ酵素の複数のCysのうち、特定のCysがよりラベル化されていればホットスポットの可能性が高い
- 十分な反応性を示すCys残基 … 複数のケモプロテオミクスデータセットで繰り返しプローブと反応し、ラベリングされているもの
要するに、「触媒活性を邪魔せず、かつ、リガンドがアクセスしやすく反応性が高いCys残基」があればよい、という感じです。
以上を目標に解析を行った結果、OUTB1という脱ユビキチン化酵素が、 触媒C91とは別の箇所C23に適したCys残基を持つことがわかりました。
ところで、シグナル分子としてのユビキチン修飾は多様性があり、ポリユビキチン鎖の連結の仕方によってシグナルの意味合いが異なることが知られています。 プロテアソーム分解のシグナルとなるのは、「ユビキチンの48番目のリジン」を介して連なったポリユビキチン鎖(K48鎖)です。
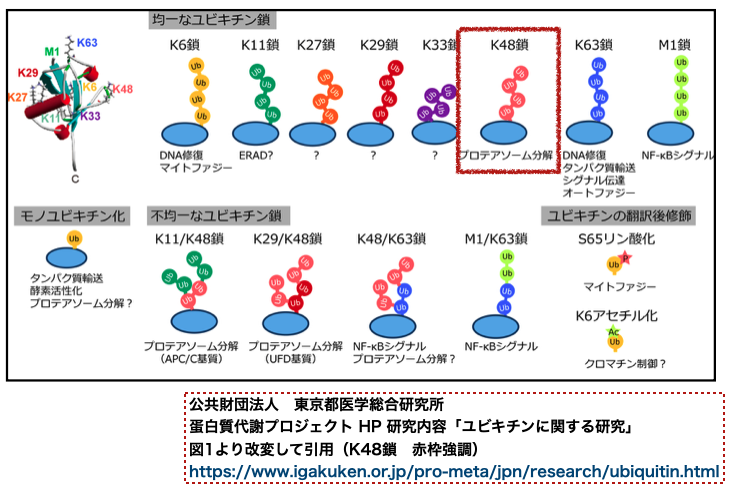
幸いなことに、OUTB1は発現量が高く、かつK48鎖を標的として切断する脱ユビキチン化酵素でした。 まさしく今回の目的にピッタリな酵素だったわけです。
共有結合性リガンドの探索
標的のDUB、OUTB1が定まったので、この酵素に対して適した共有結合性のリガンドを探索しています。ここでもABPPが活躍しています。
探索結果、共有結合部位としてアクリルアミドユニットをもつ化合物EN523を見出しています。 EN523はC23選択的に反応する化合物で、OUTB1の触媒ドメインのCys(C91)との反応はみられませんでした。
EN523の結合によりOUTB1の脱ユビキチン化活性が失われないことは別途in vitro再構成系で確認しています。

これで、DUBTACデザイン戦略のうち、脱ユビキチン化酵素側の課題2つがクリアできました。 つづいてPOC取得に向けた標的タンパク質とリガンドの選択です。
変異CFTRと低分子医薬品 Lumacaftor
DUBTACを開発するモチベーションとして、疾患の中にはミスフォールドする変異タンパクしか作れなくなり、 ユビキチン-プロテアソーム系で分解されて、機能を発揮できなくなってしまうことでおこるものがある、ということがあげられます。
そのような疾患の例として、CFTRという遺伝子の変異でおこる嚢胞性繊維症(Cystic Fibrosis、CF)があります。 CFでは複数の変異が知られていますが、中でも最も頻度の高いPhe508の欠失したΔF508-CFTRでは、 タンパク質が不安定化し、K48ポリユビキチン化修飾-分解されてしまいます。
ΔF508-CFTRに対してはすでに低分子医薬品Lumacaftorが開発されています。 LumacaftorはCFTRに結合して安定化し、フォールディングを助けるケミカルシャペロンと呼ばれる種類の化合物です。
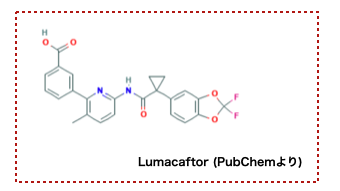
しかしながらLumacaftorを用いても完全にCFTRタンパクをレスキューできるわけではなく、多くが分解されてしまうそうです。 つまり、「タンパク質本来の機能を妨げないが結合するリガンド」があり、尚且つまだ効果が不十分というわけです。
このリガンドをDUBTACの標的タンパク側の結合ユニットとして使ってキメラ分子を作成すれば、 さらなるタンパク安定化効果が期待でき、コンセプト検証できるのでは??、ってなわけです。
DUBTACの合成とTPS効果の検証
さて、DUBTACのコンセプト検証に向けた材料が出揃いました。
脱ユビキチン化酵素 OUTB1と結合するリガンド EN523と、標的タンパクCFTRに結合するリガンド Lumacaftorを長さの異なるアルキル鎖(C3、C5)でつなぎ、 2つの化合物NJH-2-056、NJH-2-057が合成されました。
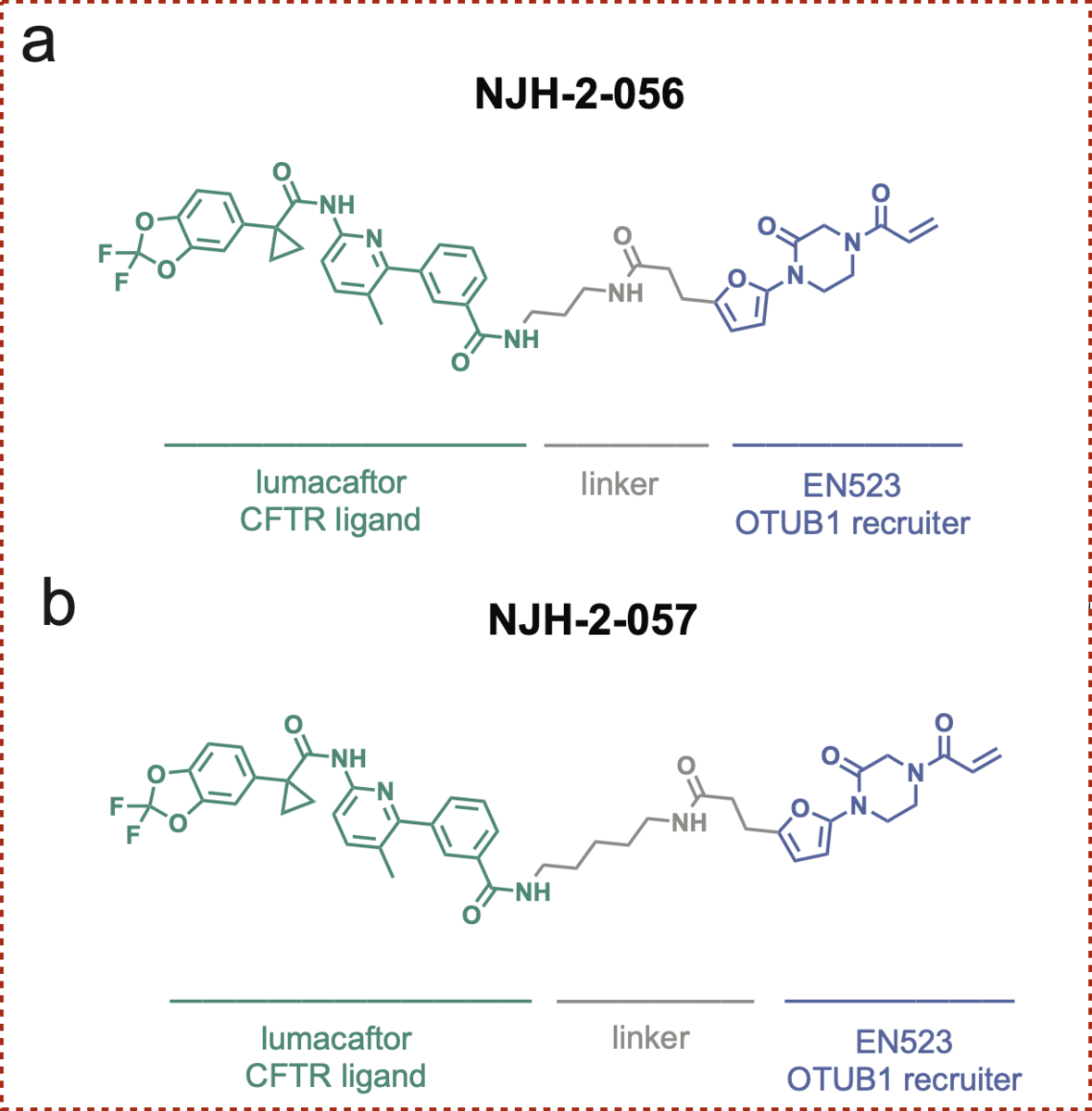
これらの化合物により変異CFTRの安定化は達成されたでしょうか? ΔF508-CFTRを発現するヒト気管支上皮細胞株(CFBE41o-4.7)をもちいてその効果を確かめています。
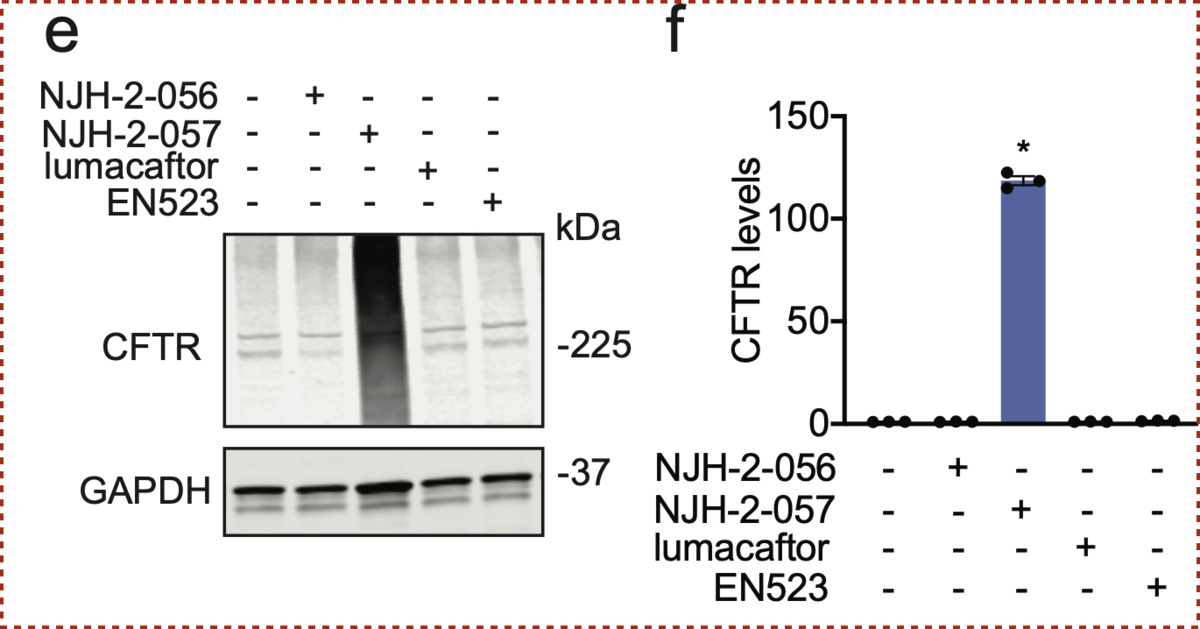
上図の通り、リンカーのアルキル鎖C5としたNJH-2-057において、Lumacaftor単独では観測できなかったCFTRの安定化、増加が確認されました。
興味深いことに、アルキル鎖を短くしたNJH-2-056では効果が確認できず、リンカーの長さの影響を受けることがわかりました。
論文ではこの他に「NJH-2-057が狙い通りのDUBTACとして機能しているか?」メカニズムに関する実験や、「安定化効果が標的タンパク(ΔF508-CFTR)選択的なものか」 といったことに関する実験も行われています。
以上、bioRxivの論文の内容でした。
感想
さて、DUBTACによるTargeted protein stabilization (TPS)、コンセプトが明快で効果検証されており、非常に面白いアプローチだと思いました。
共有結合性のリガンドをうまく活用して、新しい機能を持つハイブリッドな化合物をつくってしまうあたり、 ケミカルバイオロジーの面目躍如という感じでとてもワクワクしますよね!
ただし今回の論文は細胞レベルでの効果検証までなので、実用化にはまだまだハードルはたくさんありそうです。
- 分子量800近くあるけど、膜透過や薬物動態はどうなの?
- DUB側が共有結合性だけど、効果の持続とか、DUBの半減期の影響は?
- ユビキチンを付け外しが繰り返されると小胞体ストレスかかりそうだけど大丈夫?
- あれ、そもそもLumacaftorのシャペロン効果が今回の系で確認できてないのは良いんですか?
などなど、私には一読では分からないことがいっぱいです。詳しい方教えてください。
期待
で、いちゃもんつけつつワクワクしているのは、アカデミックな検証だけでおわらないことに期待しているからです。
まず、Novartis社が関わっていそうという点。嚢胞性繊維症の治療薬というと私はVertex社のイメージが強いです。*8 ところが不勉強なので、今更ながらNovartis社がCFTR標的薬 icenticaftor(QWD251)を開発されていることを知りました。
Discovery of Icenticaftor (QBW251), a Cystic Fibrosis Transmembrane Conductance Regulator Potentiator with Clinical Efficacy in Cystic Fibrosis and Chronic Obstructive Pulmonary Disease Journal of Medicinal Chemistry Article ASAP DOI: 10.1021/acs.jmedchem.1c00343 https://pubs.acs.org/doi/abs/10.1021/acs.jmedchem.1c00343
多種多様な研究開発・新規技術を実用化する力のあるメガファーマが治療薬開発に取り組んでいると聞くと、新たなアプローチが可能になるのではないか、と期待してしまいます。
また、逆にベンチャー企業の例として、同様のアプローチを掲げているStablix Therapeuticsという会社があるそうです。 最近できたばかりのようです。*9(シリーズAってなんですか??)
今回の記事で取り上げた論文の著者らとは別のグループの研究者らのようですが、HPで掲げられているアプローチや標的を見る限り類似の戦略をとっているようです。
興味深いのはCo-Founderの一人、Scott A. Kanner博士が以下の論文のファーストオーサーという点です。(課金してないので読んでません。すみません。)
Kanner, S.A., Shuja, Z., Choudhury, P. et al. Targeted deubiquitination rescues distinct trafficking-deficient ion channelopathies. Nat Methods 17, 1245–1253 (2020). https://doi.org/10.1038/s41592-020-00992-6 Targeted deubiquitination rescues distinct trafficking-deficient ion channelopathies | Nature Methods
こちらの論文はAbstractを見る限り人工脱ユビキチン化酵素の開発のようで、キメラ分子のアプローチとは異なりますが、 メカニズムに知見のある研究者が深く関わっているベンチャー企業がどんな化合物を作り出すのか?、楽しみです。*10
まとめ
以上、PROTACの逆をいくかのようなアプローチ、脱ユビキチン化酵素を利用するキメラ分子によるタンパク安定化の文献紹介でした。 私は専門家ではないので、このアプローチがどれくらい実用可能なものか?全く想像がつきません。*11
ですが、非専門家の私でも「なるほど!面白い!」と思える分かりやすい戦略を打ち出していて、それを実際の化合物構造として実現化している、という点で非常に興味深かったです。 また、異なる複数のグループが同じアプローチを目指しているようなのもびっくりしました。私が不勉強なだけでよく知られた手法なのでしょうか?どんどん競争が激しくなりそうです。
いずれにせよ、低分子(中分子?)化合物でできるアプローチもどんどんと進化していて楽しいですね!
毎度毎度、浅い理解で書いているので間違いが多そうです。ご指摘いただけると幸いです。ではでは!
*1:FDA grants accelerated approval to sotorasib for KRAS G12C mutated NSCLC
*2:Fragments in the clinic: AMG 510
*3:CC-BY-NC-ND 4.0 International license
*5:Novartis プレスリリースよりNovartis and UC Berkeley collaborate to tackle 'undruggable' disease targets
*6:この辺りの米国の事情は私は詳しくないので間違っていたらすみません。
*7:ABPPについてはChem-Stationさんの記事「活性ベースタンパク質プロファイリング Activity-Based Protein Profiling」の説明と図が分かりやすいです。
*8:本当に格好いいですよね。尊敬しています。
*9: Stablix Therapeutics Launches with $63 Million Series A Financing
*10:なお、上記論文は今回のbioRxivの文献にも引用されています。むしろ私はこちらの文献からbioRxivに辿り着きました。